オゾンがヒト歯肉線維芽細胞のコラーゲンタイプ1および炎症性サイトカイン産生に与える影響
牧田佳真1, 今村泰弘2, 益野一哉3, 田村功4, 藤原眞一1, 塩田剛太郎5, 芝燁彦6, 王宝禮7*
1大阪歯科大学歯学部化学教室, 大阪, 日本
2松本歯科大学歯学部薬理学講座, 長野, 日本
3大阪歯科大学歯学部歯科教育室, 大阪, 日本
4大阪歯科大学歯学部口腔解剖学講座, 大阪, 日本
5 VMC株式会社, 東京, 日本(現メディプラス製薬)
6昭和大学歯学部補綴学講座, 東京, 日本
7大阪歯科大学歯学部細菌学講座, 大阪, 日本
要約
オゾンは、強力な抗菌作用を持ち、微生物に薬剤耐性を引き起こさないため、口腔内消毒剤として検討されています。本研究では、酵素免疫測定法を用いて、in vitroでヒト歯肉線維芽細胞(HGF)におけるコラーゲンタイプ1および炎症性サイトカインの産生に対するオゾン曝露の影響を調査しました。0.5 ppmのオゾンを追加すると、HGFによるコラーゲンタイプ1の産生が24時間以内に有意に増加しました。リポポリサッカライド(LPS)で処理されたHGFによる炎症性サイトカインのインターロイキン-6(IL-6)およびIL-8の分泌は、オゾンが存在する場合に減少しました。これらの結果は、臨床でのオゾンの使用が、微生物病原体への曝露後の炎症と組織の消失を促進する一方で、HGFを介した歯周組織の維持と修復のバランスを促進することを示唆しています。
キーワード:
オゾン; コラーゲン; 歯周病; ヒト歯肉線維芽細胞
はじめに
オゾンは現在、歯科における代替の口腔消毒剤として検討されています。その強力な抗菌効果は、水の浄化や食品の保存技術においても以前から注目されています[1-3]。歯科領域では、オゾンは虫歯菌の除去、根管の消毒、外傷歯のリンスとして使用されています[4-8]。しかし、オゾンは不快な臭いがあり、約40分の短い半減期です。[9]。オゾンは水に溶けにくく、オゾン水は長期的な殺菌効果を提供しません。一方、オゾンジェル(VMC Co. Ltd. 東京、日本)は、グリセリン溶液にオゾンを含むもので、長期的な殺菌効果を持ちます。オゾンジェルの利点には、6か月間の殺菌効果、不快な臭いの欠如、およびオゾン耐性を示す細菌株の発生がないことが挙げられます。我々の研究では、皮膚および眼に対するオゾンの安全性評価、オゾンジェルを使用した抗菌効果および止血効果を報告しています[10-12]。
さらに、いくつかの報告では、オゾンが歯周病の改善に貢献する可能性が示されています[13-15]。
しかし、歯周病に関連する細胞の機能に対するオゾンの影響は未だ明らかにされていません[16-19]。
歯周病は、多くの細胞とサイトカインネットワークによって引き起こされ、その要因は複雑です。したがって、培養細胞を使用した基礎研究からのデータ収集は、病気の発症および進行を理解するための重要なツールです。本研究では、オゾンがヒト歯肉線維芽細胞(HGF)の炎症性サイトカインおよびI型コラーゲンの産生に与える影響をin vitroで検討し、歯周病に対するオゾンの作用機序を解明しようとしました。
材料および方法
細胞培養
HGF細胞は、10%胎牛血清、100単位/mlペニシリンG、100μg/mlストレプトマイシンを含むダルベッコ改変イーグル培地(DMEM培地、日水製薬株式会社、東京、日本)で、37°C、5%CO2および95%空気の湿潤インキュベーターで培養しました。本研究で使用したHGFは、適切なインフォームドコンセントを得た後、ボランティアから提供されたものです。大阪歯科大学倫理委員会は、本研究を承認しました(プロトコル110778)。慢性歯周病患者の抜歯された歯の接着歯肉組織から分離されたHGFは、コラーゲンコートプレート上で培養されました。
試薬
次の材料と抗体を購入しました: 100ppmオゾンジェル(VMC Co. Ltd.); Porphyromonas gingivalis(P. gingivalis)由来のリポポリサッカライド(LPS)(InvivoGen、サンディエゴ、CA、米国); 抗インターロイキン(IL)-6および生物チン化抗インターロイキン-6抗体(eBiosciences、サンディエゴ、CA、米国); 抗インターロイキン-8および抗インターロイキン-8抗体(R&D Systems、ミネアポリス、MN、米国); 抗I型コラーゲン抗体(Rockland、リメリック、PA、米国); 3-(4,5-ジメチルチアゾール-2-イル)-2,5-ジフェニルテトラゾリウムブロミド(MTT)(シグマアルドリッチ、セントルイス、MO、米国); BrdU(5-ブロモ-2′-デオキシウリジン)細胞増殖アッセイキット(Millipore、ビレリカ、MA、米国)。
DNA合成およびMTTアッセイ
DNA合成の解析のために、HGF(1×104/cm2)は0.5%胎牛血清を含むDMEM培地(0.5%DMEM培地)で24時間培養されました。その後、希釈したオゾンジェルを0.05、0.5、および5 ppmで2分間培養し、培地を除去しました。その後、0.5%DMEM培地で洗浄し、BrdUを含む0.5%DMEM培地で24時間培養しました。細胞内のDNA合成レベルは、BrdU細胞増殖アッセイキットを使用してBrdUの取り込みを測定することで決定されました。MTTアッセイのために、細胞は上記の濃度のオゾンジェルで10%胎牛血清を含むDMEM培地(10%DMEM培地)で2分間培養し、その後、10%DMEM培地で24時間培養しました。後続の手順は、他の場所で説明されている方法で行いました[20]。
酵素結合免疫吸着法(ELISA)
サイトカイン産生を検出するために、HGF(1×104/cm2)は2分間オゾンジェル(0.5 ppm)で培養され、その後、培地を除去しました。細胞はP. gingivalisリポポリサッカライド(100 ng/ml)で24時間培養し、10%DMEM培地で洗浄しました。その後、培養上清を収集し、抗インターロイキン-6(1μg/ml)および生物チン化抗インターロイキン-6(0.6μg/ml)または抗インターロイキン-8(2.5μg/ml)および抗インターロイキン-8(0.2μg/ml)抗体を使用してサイトカインレベルを測定しました。コラーゲン産生のために、HGF(1×104/cm2)は1%胎牛血清を含むDMEM培地(1%DMEM培地)でオゾンジェル(0.5 ppm)とともに2分間培養されました。細胞は洗浄後、1%DMEM培地で培養されました。I型コラーゲンレベルは抗I型コラーゲン抗体(0.2μg/ml)を使用して測定されました。ELISAは、CytoSetキット(Biosource International、Camarillo、CA、米国)のユーザーマニュアルに記載されている方法で実施されました[21]。コラーゲン産生のための細胞は0.5%TritonX-100で溶解され、細胞溶解液からのタンパク質の量はBCAタンパク質アッセイキット(Pierce Biotechnology、Rockford、IL、米国)を使用して測定されました。コラーゲン産生は、細胞溶解液の総タンパク質量に対して標準化されました。
統計解析
定量データは、Tukeyの検定またはStudentのt検定に続く一方向分散分析(ANOVA)を使用して統計解析されました。p<0.05で有意差があると見なしました。
結果
HGFの細胞生存率に対するオゾンの影響をMTTアッセイを使用して調べました(図1)。0.5 ppmの投与量までは、オゾンはHGFに対して顕著な細胞毒性を示しませんでしたが、5 ppmでは、未処理のコントロールに比べて約20%の細胞生存率の低下を引き起こしました。これらの結果は、このレベルのオゾンがHGFに対して細胞毒性を持つ可能性があることを示唆しています。したがって、本研究の条件はHGFに対して細胞毒性を示さない範囲に絞り、以下の実験は0.5 ppmのオゾンを使用して行いました。
次に、HGFのI型コラーゲン産生能力に対するオゾンの影響を評価しました。これは、歯周組織の再生能力に直接関連しています(図2)。細胞生存率の評価時にコントロールと比較して細胞増殖を促進したこのレベルのオゾンは、HGFによるI型コラーゲンの産生も約1.6倍に増強しました。
HGFによる炎症性サイトカインの分泌に対するオゾンの影響を図3に示します。歯周病原菌P. gingivalis由来のリポポリサッカライドによる刺激を受けたHGFは、インターロイキン-6およびインターロイキン-8の産生が著しく促進されましたが、オゾンの存在下での刺激時には、これらのインターロイキンの産生が著しく抑制されました。
考察
生活習慣病と関連することが判明している歯周病は、宿主と口腔内に生息する歯周病原菌との複雑な相互作用および機械的ストレスによって引き起こされる生物学的反応です。一般に、歯周組織の破壊および損傷の進行は、細菌の塊(プラーク)による刺激の結果として歯周組織の細胞によって放出されるさまざまなサイトカインによって引き起こされます。実際、炎症性歯周組織においては、インターロイキン-6およびインターロイキン-8などのサイトカインの濃度が増加することが知られています[22]。
インターロイキン-6は多機能を持ち、免疫細胞の分化および増殖の調節機能に加えて[23]、骨吸収を誘導することで歯周病を悪化させます[24]。
インターロイキン-8は好中球を誘導することで歯周組織の破壊に関与していると考えられています[25-26]。
さらに、マクロファージやリンパ球などのさまざまな細胞が、歯周病の悪化に複雑に関与していることが知られています。これらの中で、HGFは歯肉結合組織に最も多く存在する細胞です。HGFは、コラーゲンの産生、歯周組織の構造の構築、および恒常性の維持を担っています[27]。
病原菌やその成分であるリポポリサッカライドに曝露されると、インターロイキン-6およびインターロイキン-8などの炎症性サイトカインを分泌し、歯周組織の破壊を引き起こします[27-28]。さらに、これらのサイトカインの分泌は、慢性炎症にも強く関与していることが報告されています[29]。 我々のin vitro研究では、オゾンがHGFによるI型コラーゲンの産生を促進し、リポポリサッカライドによる炎症性サイトカイン(インターロイキン-6およびインターロイキン-8)の産生を抑制することが確認されました(図3)。さらに、HGFは病原菌の受容体として広く知られているToll様受容体(TLR)1-5および9の遺伝子を発現することが以前から報告されており、特にTLR-2、3、4および5がインターロイキン-8の発現に特異的に関与していることが報告されています[30]。TLR-2はインターロイキン-6の発現にも関与していることが知られています[31]。したがって、これらの結果は、病原菌刺激に続くこれらのサイトカインの産生増強を支持しています。
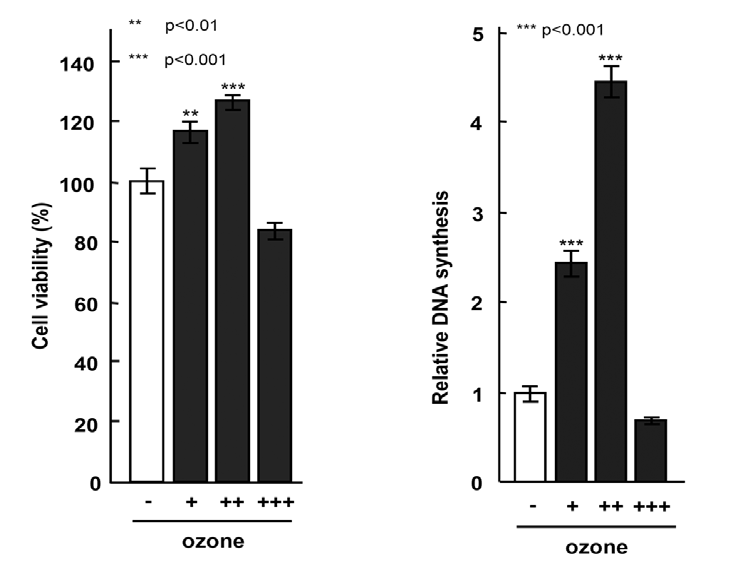
ヒト歯肉線維芽細胞は、0.05、0.5、または5 ppmのオゾンジェル(+、++、+++で示される)を含む培地に曝露されました。すべてのデータは、オゾンジェルなしのコントロール培地で処理された細胞と比較されました。データは平均±標準偏差(n=5)として提供されています。p<0.01および*p<0.001、ANOVAとDunnettの検定で分析(コントロール対比)。
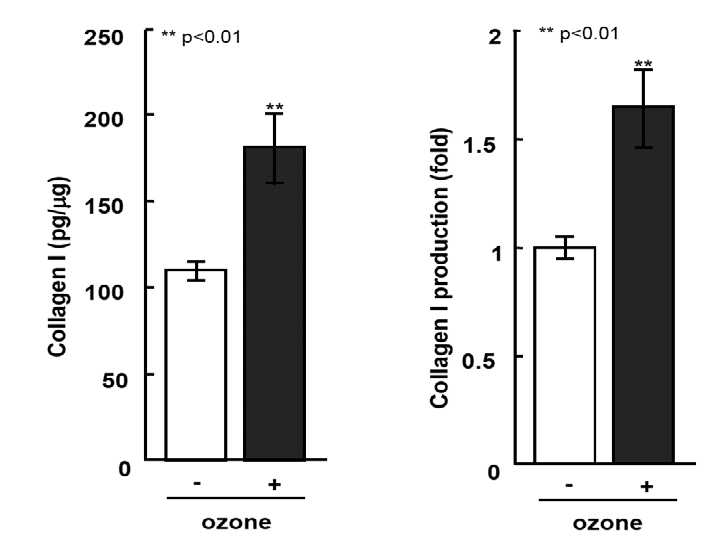
ヒト歯肉線維芽細胞は0.5 ppmのオゾンを含む培地に曝露されました。データは平均±標準偏差(n=5)として提供されています。**p<0.01、Studentのt検定で分析(コントロール対比)。
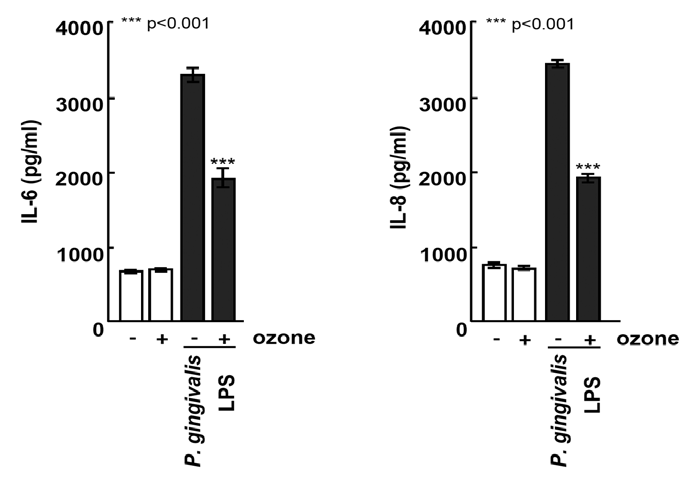
ヒト歯肉線維芽細胞は0.5 ppmのオゾンを含む培地に曝露されました。上清中のIL-6およびIL-8の濃度は、ELISAを使用して測定されました。データは平均±標準偏差(n=5)として提供されています。***p<0.001、ANOVAとTukeyの検定で分析。LPS投与時のオゾン(+/-)曝露間の統計的差異が図に示されています。
結論
結論として、我々はオゾンがin vitroで一次HGFからのI型コラーゲンの産生を増加させ、炎症性サイトカインの分泌を阻害することを示しました。HGFの細胞増殖およびDNA合成は、0.5 ppmのオゾンによって促進され、I型コラーゲンの産生も同様に促進されました。対照的に、このオゾン投与量はP. gingivalisリポポリサッカライドを用いた刺激によって誘発されたHGFのインターロイキン-6およびインターロイキン-8の産生を抑制しました。これらの結果は、臨床でのオゾンの使用が、HGFによる歯周組織の維持と修復、および微生物病原体への曝露後の炎症と組織変性の刺激との間でポジティブなバランスを促進することを示唆しています。
参考文献
- Paraskeva P, Graham NJ. (2002) Ozonation of municipal wastewater effluents. Water Environ Res 74: 569-581.
- Restaino L, Frampton EW, Hemphill JB, Palnikar P. (1995) Efficacy of ozonated water against various food-related microorganisms. Appl Environ Microbiol 61: 3471-3475.
- Unal R, Kim JG, Yousef AE. (2001) Inactivation of Escherichia coli O157: H7, Listeria monocytogenes and Lactobacillus leichmannii by combinations of ozone and pulsed electric field. J Food Prot 64: 777-782.
- Baysan A, Lynch E. (2004) Effect of ozone on the oral microbiota and clinical severity of primary root caries. Am J Dent 17: 56-60.
- Ebensberger U, Pohl Y, Filippi A. (2002) PCNA expression of cementoblasts and fibroblasts on the root surface after extraoral rinsing for decontamination. Dent Traumatol 18: 262-266.
- Huth KC, Paschos E, Brand K, Hickel R. (2005) Effect of ozone on non-cavitated fissure carious lesions in permanent molars. A controlled prospective clinical study. Am J Dent 18: 223-228.
- Kumar M, Haldia A, Gupta R, Meena D. (2015) Ozone therapy in dentistry- a review. J Sci Tech 1: 181-185.
- Nogales CG, Ferrari PH, Kantorovich EO, Lage-Marques J. (2008) Ozone therapy in medicine and dentistry. J Contemp Dent Pract 9: 75-84.
- Bocci V. (2002) Oxygen-ozone therapy: a critical evaluation. Springer Science & Business Media, Dordrecht.
- Wang PL, Shiota G, Shiba A. (2011) Safety evaluation of ozone gel for skin and eye on animal experiments. J Hard Tissue Biol 20: 313-318.
- Fukui T, Masuno K, Makita Y, Fujiwara SI, Shiota G, et al. (2014) Antimicrobial effects of ozone gel against periodontal bacteria. J Hard Tissue Biol 23: 445-448.
- Sakai D, Makita Y, Masuno K, Fujiwara SI, Okazaki J, et al. (2014) Local hemostatic effect of aqueous ozone in cutting wound surface. J Hard Tissue Biol 23: 245-248.
- Srikanth A, Sathish M, Sri Harsha AV. (2013) Application of ozone in the treatment of periodontitis. J Pharm Bioallied Sci 5: S89-S94.
- Saini R. (2011) Ozone therapy in dentistry: A strategic review. J Nat Sci Biol Med 2: 151-153.
- Arpita R, Swetha JL, Babu MR, Sudhir R. (2014) Recent trends in non-surgical periodontal care for the general dentist-a review. Bangl J Dent Res Edu 4: 78-82.
- Wang G, Umstead TM, Phelps DS, Al-Mondhiry H, Floros J. (2002) The effect of ozone exposure on the ability of human surfactant protein a variants to stimulate cytokine production. Environ Health Perspect 110: 79-84.
- Li Z, Tighe RM, Feng F, Ledford JG, Hollingsworth JW. (2013) Genes of innate immunity and the biological response to inhaled ozone. J Biochem Mol Toxicol 27: 3-16.
- Huang W, Wang G, Phelps DS, Al-Mondhiry H, Floros J. (2004) Human SP-A genetic variants and bleomycin-induced cytokine production by THP-1 cells: effect of ozone-induced SP-A oxidation. Am J Physiol Lung Cell Mol Physiol 286: 546-553.
- Mikerov AN, Umstead TM, Gan X, Huang W, Guo X, et al. (2008) Impact of ozone exposure on the phagocytic activity of human surfactant protein A (SP-A) and SP-A variants. Am J Physiol Lung Cell Mol Physiol 294: 121-130.
- Imamura Y, Fujigaki Y, Oomori Y, Usui S, Wang PL. (2009) Cooperation of salivary protein histatin 3 with heat shock cognate protein 70 relative to the G1/S transition in human gingival fibroblasts. J Biol Chem 284: 14316-14325.
- Imamura Y, Wang PL. (2014) Salivary histatin 3 inhibits heat shock cognate protein 70-mediated inflammatory cytokine production through toll-like receptors in human gingival fibroblasts. J Inflamm (Lond) 11: 4.
- Noh MK, Jung M, Kim SH, Lee SR, Park KH, et al. (2013) Assessment of IL‑6, IL‑8 and TNF‑α levels in the gingival tissue of patients with periodontitis. Exp Ther Med 6: 847-851.
- Hirano T, Akira S, Taga T, Kishimoto T. (1990) Biological and clinical aspects of interleukin 6. Immunol Today 11: 443-449.
- Ishimi Y, Miyaura C, Jin CH, Akatsu T, Abe E, et al. (1990) Interleukin-6 is produced by osteoblasts and induces bone resorption. J Immunol 145: 3297-3303.
- Okada H, Murakami S. (1998) Cytokine expression in periodontal health and disease. Crit Rev Oral Biol Med 9: 248-266.
- Wentworth P Jr, McDunn JE, Wentworth AD, Takeuchi C, Nieva J, et al. (2002) Evidence for antibody-catalyzed ozone formation in bacterial killing and inflammation. Science 298: 2195-2199.
- Ara T, Fujinami Y, Urano H, Hirai K, Hatori T, et al. (2012) Protein kinase A enhances lipopolysaccharide-induced interleukin-6, interleukin-8 and PGE2 production by human gingival fibroblasts. J Periodontal Res 44: 21-27.
- Wang PL, Ohura K, Fujii T, Oido-Mori M, Kowashi Y, et al. (2003) DNA microarray analysis of human gingival fibroblasts from healthy and inflammatory gingival tissues. Biochem Biophys Res Commun 305: 970-973.
- Ara T, Kurata K, Hirai K, Uchihashi T, Imamura Y, et al. (2009) Human gingival fibroblasts are critical in sustaining inflammation in periodontitis. J Periodontal Res 44: 21-27.
- Mahanonda R, Sa-Ard-Iam N, Montreekachon P, Pimkhaokham A, Yongavinichit K, et al. (2007) IL-8 and IDO expression by human gingival fibroblasts via TLRs. J Immunol 178: 1151-1157.
- Souza PP, Palmqvist P, Lundgren I, Lie A, Costa-Neto CM, et al. (2010) Stimulation of IL-6 cytokines in fibroblasts by toll-like receptors 2. J Dent Res 89: 802-807.