オゾンジェルがヒト骨肉腫細胞株Saos-2による骨基質産生に与える影響
王宝禮1)*, 田地 陽一2)*, 益野 一哉1), 大草 亘孝3) 今村 泰弘4)
1) 大阪歯科大学歯学教育室、大阪、日本
2) 東京家政大学栄養生理学研究室、東京、日本
3) 大阪歯科大学歯学部法歯学講座、大阪、日本
4) 松本歯科大学歯学部薬理学講座、塩尻、日本
(2018年4月20日受理)
要旨
オゾンは、抗菌性が高く、微生物の耐性を誘導しないため、現在、潜在的な口腔消毒剤として検討されています。本研究では、最適な用量のオゾンジェルが、in vitroでSaos-2細胞の増殖、I型コラーゲンの産生、およびアルカリホスファターゼ(ALP)の分泌を促進することを示しました。Saos-2細胞の増殖は、MTTおよびDNA合成アッセイにより評価されました。I型コラーゲンの産生およびALPの分泌は、酵素結合免疫吸着法(ELISA)およびALPアッセイを使用して評価されました。細胞は、0.05、0.5、5 ppmのオゾンジェルで24時間処理されました。オゾンジェル(0.5 ppm)は、Saos-2細胞の増殖を有意に誘導しました。この濃度では、オゾンジェルはI型コラーゲンの産生およびALPの分泌を促進しました。結果は、オゾンジェルが骨芽細胞の細胞代謝を制御し、初期の骨関連バイオマーカーの分泌をもたらすことを示唆しています。
キーワード
オゾンジェル、ALP、コラーゲン、骨芽細胞、Saos-2細胞
序論
オゾンは現在、潜在的な代替口腔消毒剤として歯科領域で検討されています。その強力な抗菌効果は、薬剤耐性を伴わないため、水の浄化や食品保存技術において以前から注目されています1-3)。歯科では、オゾンはガス状または水溶液の形で、う蝕を引き起こす病原菌の除去、根管の消毒、脱臼した歯の洗浄に使用されてきました4-8)。しかし、オゾンには不快な臭いがあり、半減期が約40分と短いです9)。また、オゾンは水に溶けにくいため、水溶性オゾン製剤は長期的な殺菌効果を提供しません。一方、オゾンを含むグリセリン溶液からなるオゾンジェルは、長期的な殺菌効果を持ちます。オゾンジェルの利点には、6か月間の殺菌効果、不快な臭いの欠如、およびオゾン耐性を示す細菌株の発生がないことが含まれます。以前に、我々はオゾンの皮膚および眼に対する安全性評価、抗菌効果、および止血における役割をオゾンジェルを用いて報告しました10-12)。さらに、多くの報告がオゾンが歯周病を改善できることを示しています13-15)。しかし、歯周病に関与する細胞の機能に対するオゾンの影響はまだ解明されていません16-19)。最近、我々はin vitroでヒト歯肉線維芽細胞(HGFs)における炎症性サイトカインとI型コラーゲンの産生に対するオゾンジェルの影響を報告し、歯周病に対するオゾンの作用機序を解明しようと試みました20)。本研究では、ヒト骨肉腫細胞株Saos-2におけるI型コラーゲン産生およびアルカリホスファターゼ(ALP)の分泌に対するオゾンジェルの影響を検討しました。
材料と方法
細胞培養
Saos-2細胞(RIKEN BRC Cell Bank, 東京、日本)は、10%胎牛血清(FBS)、100単位/ mlペニシリンG、および100 μg/ mlストレプトマイシンを含むダルベッコ改変イーグル培地(DMEM, 日水製薬株式会社、東京、日本)で、37°C、5%CO2および95%空気の湿潤インキュベーターで培養しました。
DNA合成およびMTTアッセイ
DNA合成のために、Saos-2細胞(1×104)は0.5%FBSを含むDMEM(0.5%DMEM)で24時間培養しました。細胞はオゾンジェル(VMC株式会社、東京、日本)または0.05、0.5、5ppmで2分間培養され、その後培地を除去しました。次に、細胞は0.5%DMEMで洗浄され、ブロモデオキシウリジン(BrdU)を含む0.5%DMEMで24時間培養されました。DNA合成のレベルは、BrdU細胞増殖アッセイキット(Millipore、東京、日本)を使用してBrdU取り込みを測定することにより決定しました。
MTT(3-(4,5-ジメチルチアゾール-2-イル)-2,5-ジフェニルテトラゾリウムブロミド、Sigma-Aldrich)アッセイの場合、細胞は10%FBSを含むDMEM(10%DMEM)で2分間オゾンジェル(0.05、0.5、5ppm)と共に培養され、その後培地が除去しました。10%DMEMで洗浄後、細胞は10%DMEMで24時間培養しました。その後の手順は別途記載された方法に従って実施しました21)。
酵素結合免疫吸着法(ELISA)
コラーゲン産生のために、Saos-2細胞(1×104)はオゾンジェル(0.5ppm)と共に1%FBSを含むDMEM(1%DMEM)で2分間培養しました。細胞は洗浄され、1%DMEMで培養されました。培地中のI型コラーゲンのレベルは、ビオチン化抗I型コラーゲン抗体(0.2 μg/ml、Rockland)を使用して測定しました。ELISAは、CytoSetキット(Biosource、東京、日本)のユーザーマニュアルに記載された方法に従って実施しました22)。コラーゲン産生のための細胞は0.5%TritonX-100で溶解され、細胞溶解液のタンパク質濃度はビシンコニン酸(BCA)タンパク質アッセイキット(Pierce、東京、日本)を使用して測定されました。コラーゲン産生は細胞溶解液のタンパク質含量に実施しました。
ALP活性
Saos-2細胞(1×104)はオゾンジェル(0.5ppm)と共に2分間培養され、その後培地が除去しました。細胞は0.5%DMEMで洗浄され、10%DMEMで24時間培養されました。細胞は0.05%TritonX-100で溶解され、溶解液のALP活性はLabAssay ALPキット(和光純薬工業株式会社、大阪、日本)を使用して測定しました。細胞溶解液のタンパク質濃度もBCAタンパク質アッセイキットを使用して測定しました。ALP活性は細胞溶解液のタンパク質含量を測定しました。
統計解析
定量データはStatMateソフトウェア(ATMS)を使用して、一元配置分散分析(ANOVA)に続いてTukeyの検定(DNA合成およびMTTアッセイ)またはスチューデントのt検定(ALP活性の測定およびコラーゲン産生のためのELISA)を使用して統計的に解析しました。差異はp < 0.05で有意と見なしました。
J Hard Tissue Biology Vol. 27(3):195-198, 2018
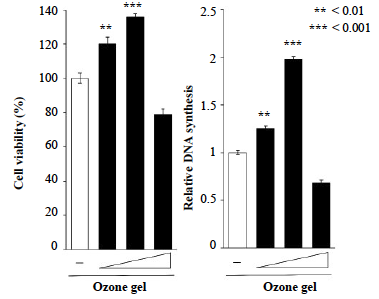
(a) MTTアッセイ。 (b) DNA合成アッセイ。3.1 × 104/cm2の容量で播種されたSaos-2は、0.05、0.5、5 ppmのオゾンジェルを含む培地(+, ++, +++として指定)に24時間曝露しました。すべてのデータはオゾンジェルを含まないコントロール培地で処理された細胞と比較しました。データは平均値±標準偏差(n = 3)として提供しました。 **P < 0.01および***P < 0.001、ANOVAおよびDunnettの検定(vs.なし)で解析しました。
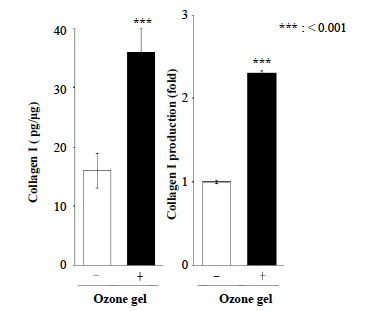
3.1 × 104/cm2の容量で播種されたSaos-2細胞は、0.5 ppmのオゾンジェルを含む培地に24時間曝露しました。データは平均値±標準偏差(n = 3)として提供しました。 ***P < 0.001、スチューデントのt検定(vs.なし)で解析しました。
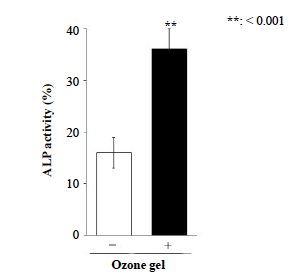
3.1 × 104/cm2の条件で播種されたSaos-2は、0.5 ppmのオゾンジェルを含む培地に24時間曝露されました。データは平均値±標準偏差(n = 3)として提供しました。 **P < 0.01、スチューデントのt検定(vs.なし)で解析しました。
結果
オゾンジェルがSaos-2細胞の増殖に与える影響
24時間のインキュベーション後、オゾンジェル処理は用量依存的にSaos-2の増殖を増加させました(図1)。0.5 ppmのオゾンジェルは他の濃度と比較して細胞増殖を有意に誘導しましたが、0.5 ppmのオゾンジェル処理では明らかな変化は観察されませんでした。MTTアッセイの結果と同様に、0.5 ppmのオゾンジェルはSaos-2細胞におけるDNA合成を効果的に増加させ、Saos-2細胞の増殖を促進するために必要なオゾンジェルの最適濃度を示しました。
オゾンジェルがSaos-2細胞によるI型コラーゲン産生およびALP分泌に与える影響
0.5 ppmのオゾンジェルは細胞増殖を有意に誘導しました。この結果を考慮し、増殖アッセイの結果を踏まえて、0.5 ppmのオゾンジェルを使用してSaos-2細胞からのコラーゲン1産生およびALP分泌に対するオゾンジェルの効果をさらに評価しました。培地にオゾンジェルを添加することで、オゾンジェル処理を行わなかった場合と比較して、Saos-2細胞からのI型コラーゲン産生(図2)およびALP分泌(図3)が効果的に増加しました。
考察
オゾンジェルが骨芽細胞による骨基質産生に与える影響は明確ではありません。本研究では、高濃度のオゾンジェルが細胞生存率指数を低下させる一方で、低濃度のジェルが細胞増殖を促進することを示しました。さらに、0.5 ppmのオゾンジェルは骨形成に高度に関連するI型コラーゲンおよびALPの分泌を促進しました。
以前、Odaらは10 ppmのオゾンジェルがヒト歯肉線維芽細胞の増殖を抑制することを報告しました23)。本研究では、高濃度(5 ppm)のオゾンジェルで細胞増殖が有意に抑制される一方で、0.5 ppmのオゾンジェルが細胞増殖を促進することを示しました。オゾンの非ゲル形態に関する研究では、Tsujiueらはリン酸緩衝食塩水(PBS)に溶解したオゾン水が3 ppmで細胞損傷を引き起こすことを報告しました24)。肺胞マクロファージを用いた研究では、0.5 ppmのオゾンガスが単球株THP-1に細胞損傷を引き起こすことが報告されてます25)。オゾンジェルは、グリセリンに含まれるオゾンを持続的に放出する利点があります20)。これらの観察に基づき、オゾンジェルは低濃度で利用可能な場合には細胞毒性を示さずに薬理効果を発揮し、持続放出効果により効果的な濃度をさらに低減することができると結論付けられます。しかし、一定濃度以上では細胞毒性を示すホルミシス効果があります。
I型コラーゲンおよびALPは、骨形成の初期段階で分泌されるマーカーとして広く知られています20)。本研究では、これらの初期段階の骨基質マーカーがオゾンジェルの最適濃度で分泌されました。現在、適度なレベルの活性酸素種は細胞内シグナル伝達物質として機能すると考えられています。活性酸素種は、タンパク質、核酸、脂質を化学的に修飾することで細胞内シグナル伝達を制御します。これらの中で、Keep 1/Nrf2経路によるストレス適応応答の参加が活発に研究されています。しかし、Nrf2は骨芽細胞の分化を負に制御することが知られています。したがって、本研究で観察されたI型コラーゲン分泌およびALPの発現増加は、Nrf2を介さない経路によって生じた可能性が高いです。残念ながら、本研究ではこれらの初期骨基質マーカーのアップレギュレーションのメカニズムを調査しませんでした。以前の報告では、酸素オゾン療法がVEGFなどの成長因子の産生を促進することが示されています27)。さらに、オゾンガスはFGFおよび他の関連するサイトカインの産生を促進することが知られています28)。VEGFはマウス骨芽細胞株MC3T3-1におけるALP発現を促進します29)。したがって、骨基質の分泌はこれらの成長因子の分泌を介して間接的に促進された可能性があります。
本研究は、0.5 ppmのオゾンジェルが細胞損傷の兆候を示さずに骨芽細胞マトリックスの分泌を増加させることを示しています。以前の報告では、同じ濃度のオゾンジェルがコラーゲンマトリックスの分泌を促進し、LPS誘発IL-6およびIL-8の発現を抑制することが明らかにされています20)。in vitroおよびin vivoの実験結果を直接結びつけることは困難ですが、我々の結果は、オゾンガス、オゾン水、オゾンオリーブオイル30)、およびオゾンジェルが歯周病の治療剤として使用できることを示唆しています。しかし、そのような応用には、生体安全性の評価や、細胞損傷に関する長期的な効果の機能研究など、詳細な評価が必要です。
参考文献
1. Paraskeva P and Graham NJ. Ozonation of municipal wastewater effl uents. Water Environ. Res 74: 569-581, 2002
2. Restaino L, Frampton EW, Hemphill JB and Palnikar P. Effi cacy of ozonated water against various food-related microorganisms. Appl Environ Microbiol 61: 3471-3475, 1995
3. Unal R, Kim JG and Yousef AE. Inactivation of Escherichia coli O157: H7, Listeria monocytogenes, and Lactobacillus leichmannii by combinations of ozone and pulsed electric fi eld. J Food Prot 64: 777-782, 2001
4. Baysan A and Lynch E. Eff ect of ozone on the oral microbiota and clinical severity of primary root caries. Am Dent 17: 56-60, 2004
5. Ebensberger U, Pohl Y and Filippi A. PCNA expression of cementoblasts and fibroblasts on the root surface after extraoral rinsing for decontamination. Dent Traumatol 18: 262-266, 2002
6. Huth KC, Paschos E, Brand K and Hickel R. Eff ect of ozone on noncavitated fissure carious lesions in permanent molars. A controlled prospective clinical study. Am J Dent 18: 223-228, 2005
7. Kumar M, Haldia A, Gupta R and Meena D. Ozone therapy in dentistry- a review. J Sci Tech 1: 181-185, 2015
8. Nogales CG, Ferrari PH, Kantorovich EO and Lage-Marques J. Ozone therapy in medicine and dentistry. J Contemp Dent Pract 9:75-84, 2008
9. Bocci V. Mechanism of action on ozone. In: Oxygen-ozone therapy.A critical evaluation, ed by Bocci V, Maruzen Publishing, Inc.,Tokyo, 2012, pp 17-25. (in Japanese)
10. Wang PL, Shiota G and Shiba A. Safety evaluation of ozone gel for skin and eye on animal experiments. J Hard Tissue Biol 20: 313-318, 2011
11. Fukui T, Masuno K, Makita Y, Fujiwara S and Shiota G.Antimicrobial effects of ozone gel against periodontal bacteria. J Hard Tissue Biol 23: 445-448, 2014
12. Sakai D, Makita Y, Masuno K, Fujiwara S and Okazaki J. Local hemostatic eff ect of aqueous ozone in cutting wound surface. J
Hard Tissue Biol 23: 245-248, 2014
13. Srikanth A, Sathish M and Sri Harsha AV. Application of ozone in the treatment of periodontal disease. J Pharm Bioallied Sci 5: S89-94,2013
14. Saini R. Ozone therapy in dentistry: A strategic review. J Nat Sci Biol Med 2: 151-153, 2011
15. Arpita R, Swetha JL, Babu MR and Sudhir R. Recent trends in nonsurgical periodontal care for the general dentist-a review. Bangl J
Dent Res Edu 4: 78-82, 2014
16. Wang G, Umstead TM, Phelps DS, Al-Mondhiry H and Floros J. The eff ect of ozone exposure on the ability of human surfactant protein a variants to stimulate cytokine production. Environ Health Perspect 110: 79-84, 2002
17. Li Z, Tighe RM, Feng F, Ledford JG and Hollingsworth JW. Genes of innate immunity and the biological response to inhaled ozone. J
Biochem Mol Toxicol 27: 3-16, 2013
18. Huang W, Wang G, Phelps DS, Al-Mondhiry H and Floros J. Human SP-A genetic variants and bleomycin-induced cytokine production by THP-1 cells: eff ect of ozone-induced SP-A oxidation. Am J Physiol-Lung Cell Mol Physiol 286: 546-553, 2004
19. Mikerov AN, Umstead TM, Gan X, Huang W, Guo X, Wang G,Phelps DS and Floros J. Impact of ozone exposure on the phagocytic activity of human surfactant protein A (SP-A) and SP-A variants. Am J Physiol-Lung Cell Mol Physiol 294: 121-130, 2008
20. Makita Y, Imamura Y, Masuno K, Fujiwara S, Shiota G, Shiba A and Wang PL. The Eff ect of Ozone on Collagen Type-1 and Infl amatory Cytokine Production in Human Gingival Fibroblasts. Dentistry 5:339.doi:10.4172/2161-1122. 1000339, 2015
21. Imamura Y, Fujigaki Y, Oomori Y, Usui S and Wang PL. Cooperation of salivary protein histatin 3 with heat shock cognate protein 70 relative to the G1/S transition in human gingival fi broblasts. J Biol Chem 284: 14316-14325, 2009
22. Imamura Y and Wang PL. Salivary histatin 3 inhibits heat shock cognate protein 70-mediated inflammatory cytokine production through toll-like receptors in human gingival fi broblasts. J Infl amm (Lond) 11: 4, 2014
23. Oda H, Maruyama, K, Tsubokawa M, Sioda G, Kamoi H, Nagahiro K and Sato S. Eff ect of ozone gel on oral pathogens and human gingiva and periodontal ligament fi broblasts. Jpn J Conserv Den 57: 369-376, 2014
24. Tsujigami H. Sttudy of cytotoxic and bactericidal eff ects of ozonized water against periodontium-derived cells and periodontopathic bacteria. J Jpn Assoc Periodontol 44: 46-54, 2002
25. Klestadt D1, Laval-Gilly P and Falla J. Ozone-mediated cytotoxicity after short-term exposure and its relation to the production of cellular metabolites (NO, H2O2). Cell Biol Toxicol 18: 259-269, 2002
26. Miron RJ and Zhang YF. Osteoinduction: a review of old concepts with new standards. J Dent Res 91: 736-744, 2012
27. Zhang J, Guan M, Xie C, Luo X, Zhang Q and Xue Y. Increased growth factors play a role in wound healing promoted by noninvasive oxygen-ozone therapy in diabetic patients with foot ulcers. Oxid Med Cell Longev. 273475. doi: 10.1155/2014/273475, 2014
28. Rei L, martínez-sánchez G, perez-davison G and Sirito M. Role of ozone/oxygen in fi broblast growth factor activation. Discovering the Facts Int J Ozone Therapy 9: 55-58, 2010
29. Tan YY, Yang YQ, Chai L, Wong RW and Rabie AB. Effects of vascular endothelial growth factor (VEGF) on MC3T3-E1. Orthod Craniofac Res 13: 223-228, 2010
30. Srikanth A1, Sathish M and Sri Harsha AV. Application of ozone in the treatment of periodontal disease.J Phar Bioallied Sci 5: 89-94,2013


